肺结核科普
第一章
基础知识篇
一、免疫系统
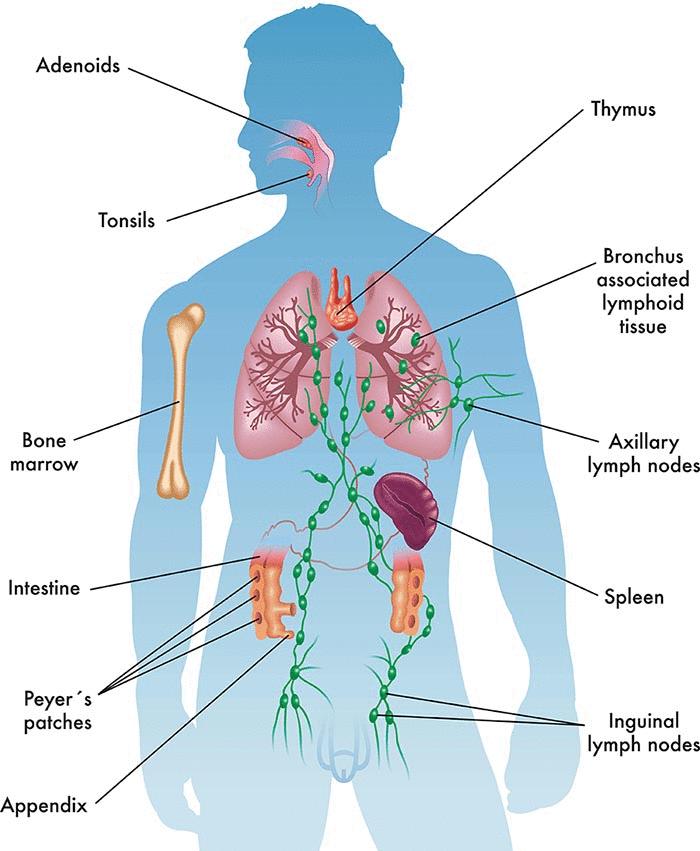
1. 免疫器官
图1 免疫器官
如上图,免疫器官是以淋巴组织为主的器官。按其功能不同分为中枢性免疫器官和外周免疫器官。中枢免疫器官是免疫细胞发生、分化和成熟的场所。在人和哺乳类动物主要是胸腺和骨髓,鸟类还包括法氏囊。外周免疫器官是成熟T细胞和B细胞定居的场所,也是这些细胞在抗原刺激下发生免疫应答的部位。外周免疫器官包括淋巴结、脾脏、黏膜相关淋巴组织等。
2. 免疫细胞
免疫细胞是指参与免疫应答或与免疫应答相关的细胞。包括淋巴细胞、树突状细胞、单核/巨噬细胞、粒细胞、肥大细胞等。以下用思维导图对B淋巴细胞和T淋巴细胞进行详细总结(图2)。
3. 免疫屏障
免疫屏障(immunological barrier)是防御异物进入机体或机体某一部位的生理解剖学结构,是发挥非特异性免疫功能的重要方面,被称为机体的“第一道防线”,包括皮肤黏膜、血脑屏障和胎盘屏障。
(1)皮肤黏膜屏障
健康完整的皮肤及粘膜包裹着机体,它们可以机械性地阻挡病原微生物及其他抗原异物侵入机体,比如:鼻孔中的鼻毛、呼吸道粘膜表面的粘液和纤毛,均能阻挡并排除抗原异物的侵入。皮肤及粘膜能经常分泌杀菌物质。皮肤的汗腺分泌的乳酸、皮脂腺分泌的脂肪酸都呈酸性,不利于病原细菌的生长。胃液中的胃酸也有很强的杀菌能力。此外,正常菌群通过其生长代谢所分泌的代谢产物,对病原菌的侵入起有效的杀伤作用。
(2)血脑屏障
血脑屏障是存在于血脑循环中的一种生理解剖学结构。它是由软脑膜、脉络丛的脑毛细血管壁和包在壁外的神经胶质细胞形成的胶质膜构成。近年来,据电镜和酶标技术研究证明,血脑屏障的组织学部位主要是脑毛细血管内皮细胞层。这层细胞具有连结紧密、胞饮作用微弱的特点,可有效地阻挡病原微生物及其他抗原异物通过血流进入脑组织或脑脊液,从而保护了机体的中枢神经系统。婴幼儿由于血脑屏障尚未发育完善,较易发生脑膜炎等中枢神经系统的感染。
(3)胎盘屏障
胎盘屏障是由母体的子宫内膜的基蜕膜和胎儿绒毛膜共同组成。此屏障不影响母子间的物质交换,但在一般情况下可防止母体内的病原菌进入胎儿体内。使胎儿免受感染。血胎屏障与妊娠期有关。在妊娠头3个月内,该屏障尚未发育完善。此时若母体患风疹等病毒性感染,则病原体可通过胎盘进入胎儿体内,常可造成胎儿畸形、流产或死亡。
第二章
肺结核
Tuberculosis is a communicable infectious disease, transmitted almost exclusively by cough aerosol, caused by the Mycobacterium tuberculosis complex, and characterized pathologically by necrotizing granulomatous inflammation usually in the lung (~85% of cases), although almost any extrapulmonary site can be involved. Tuberculosis probably emerged about 70 000 years ago, accompanied by migration of modern human beings out of Africa. It remains a global plague, and untreated, has a mortality of ~70% in smear-positive people. Tuberculosis has killed roughly 1 billion people in the past two centuries, still ranks amongst the top ten causes of death worldwide, results in substantial chronic lung disability, and reduces gross domestic product (GDP) substantially in endemic countries[1].
一、结核分枝杆菌[2]

1. 生物学性状
图7 结核分枝杆菌生物学性状

2. 致病性
图8 结核分枝杆菌生物学性状
3. 免疫性与超敏反应
人体对结核分枝杆菌的感染率较高,但发病率低,表明人体对结核分枝杆菌有较强的抵抗力。机体对结核分枝杆菌可产生抗体,如结核患者血清中抗结核分枝杆菌蛋白的特异性IgG水平明显升高,但其对机体的免疫保护作用尚不明确。机体的抗结核免疫主要是细胞免疫,包括致敏的T淋巴细胞和被激活的巨噬细胞。结核分枝杆菌的免疫性与致病性均与感染后诱发机体产生的细胞免疫应答和迟发型超敏反应有关。
(1)免疫性
感染结核分枝杆菌或接种卡介苗后,机体可产生对该菌的特异性免疫力,此种免疫力的维持依赖于结核分枝杆菌在体内的存在,称感染免疫(infection immunity),或称有菌免疫。机体的抗结核免疫主要以细胞免疫为主,一旦体内结核分枝杆菌或其组分全部消失,免疫力也随之消失。人体感染结核分枝杆菌后,靶细胞主要为单核-巨噬细胞,细菌可在细胞内长期生存,在参与炎症反应过程中,巨噬细胞逐步分化为结核结节(慢性肉芽肿)病灶中主要的细胞成分(上皮样细胞和朗格汉斯细胞);同时巨噬细胞又可通过加工处理和提呈MHC-结核抗原肽,并主要被CD4+T细胞所识别;特别应指出的是,当单核-巨噬细胞对细菌发挥吞噬、凋亡作用或诱导适当炎症反应时,细菌可被清除;而出现坏死、过度炎症(免疫病理)时,则细菌在细胞内长期生存或向周围扩散。
CD4+T细胞在抗菌细胞免疫中起重要作用。其可分泌多种细胞因子,激活巨噬细胞,通过活性氮、活性氧介导,杀死胞内的结核分枝杆菌。CD4+T细胞被激活后,由Th0细胞在相应细胞因子作用下,分化为Th1、Th2、Th17、Th22和适应性调节T细胞(Tr1、Th3)等细胞亚群,分别以各自的角色参与结核的免疫反应和致病过程。其中,Th1细胞分泌IFN-γ、IL-2、TNF-α等,作用于巨噬细胞,使其吞噬能力增强,活化的巨噬细胞能消化并杀死被吞入的结核分枝杆菌,同时后者也能释放IFN-γ等细胞因子,因此Th1在宿主抗结核菌免疫中发挥着主要作用。Th2细胞分泌IL-4、IL-5、IL-10和TGF-β,抑制Th1介导的保护性免疫应答。Th1/Th2应答失衡是结核病发生、发展的重要机制。此外,细胞毒性CD8+T细胞通过分泌颗粒溶素、穿孔素,在清除靶细胞和杀灭吞噬细胞内外的结核分枝杆菌方面发挥关键作用;还有γδT细胞、NK细胞等也发挥一定的抗结核免疫作用。
(2)免疫与超敏反应
机体获得对结核分枝杆菌免疫力的同时,菌体的一些成分也会共同刺激T淋巴细胞,形成致敏状态。当再次感染结核分枝杆菌时,体内致敏的T淋巴细胞即会释放出细胞因子,引起强烈的迟发型超敏反应,形成以单核-巨噬细胞浸润为主的炎症反应,并容易发生干酪样坏死和液化形成空洞。因此,在结核分枝杆菌感染时,细胞免疫与迟发型超敏反应同时存在。此情况可用郭霍现象(Koch’s phenomenon)说明,将一定量的结核分枝杆菌初次注入健康易感豚鼠皮下,10~14天后局部发生坏死溃疡,深而不易愈合,附近淋巴结肿大,结核分枝杆菌扩散至全身,表现为特异性细胞免疫尚未建立的感染特点。若以同种等量的结核分枝杆菌再次对已感染过的豚鼠进行皮下注射,则在1~2天内局部迅速发生坏死溃疡,但此溃疡较浅且易愈合,附近淋巴结不肿大,结核分枝杆菌亦很少扩散,表现为原发后感染的特点。郭霍现象表明,再感染时病灶局限,溃疡浅而易愈合,表明机体对结核分枝杆菌已有一定免疫力;而炎症反应发生迅速,溃疡很快形成,则说明机体在产生抗感染免疫的同时有超敏反应发生。
儿童结核病大多为初次感染,机体尚未建立免疫和超敏反应,可发生急性全身粟粒性结核和结核性脑膜炎。成年人结核大多为复发或再次感染,此时机体已建立了抗结核分枝杆菌的免疫和超敏反应,故病灶常为慢性局限性但局部病症较重,形成结核结节,发生纤维化或干酪样坏死。
因此,结核分枝杆菌的致病性可能与其在宿主体内顽强增殖、菌体成分的毒力作用和机体免疫病理反应之间的综合作用有关。
二、类型
肺结核分为五种类型,以下用表格进行总结(表1)。
表1 肺结核的类型[3]
| 原发型肺结核 | 人体初次感染结核菌后在肺内形成的病灶,并引起淋巴管炎和淋巴结炎。肺内原发病灶、淋巴管炎和肺门淋巴结炎,统称为原发综合征。多见于儿童,症状多轻微而短暂,有微热、咳嗽、食欲不振、体重减轻等,数周好转。本型大多数预后良好。 |
| 血行播散型肺结核 | 粟粒性肺结核,由结核菌侵入血循环引起。急性粟粒性肺结核起病急,全身中毒症状重如高热等,常可伴发结核性脑膜炎。亚急性或慢性血行播散型肺结核,临床上可无明显中毒症状,病情发展也较缓慢,病人常无明显感觉。 |
| 浸润型肺结核 | 继发性肺结核最常见的类型,干酪性肺炎和结核球也属此型,多见于成年人,病变好发于上叶尖、后段及下叶背段。病灶可吸收、纤维化或钙化,症状及体征随病变范围和性质相差甚大,从无明显症状到出现高热、气急等明显中毒症状,X线胸片表现为片絮状或斑点结节状阴影,可有空洞及支气管内播散灶。 |
| 慢性纤维空洞型肺结核 | 肺结核的晚期表现。浸润型肺结核未及时发现或者治疗不当,空洞长期不愈,空洞壁逐渐变厚,病灶出现广泛纤维化,病灶吸收、修复与恶化、进展交替进行,病程迁延,症状时起时伏,常并发气胸、支气管扩张,甚至呼吸衰竭。此型痰中常有结核菌,是结核病重要的传染源。 |
| 结核性胸膜炎 | 结核菌可由肺部病灶直接蔓延,也可经淋巴或血行到胸膜。青少年多见,有干性和渗出性两个阶段。前者主要表现为胸痛,并可听到胸膜摩擦音;胸液渗出时,胸痛消失,出现逐渐加重的呼吸困难。 |
三、发病机制
结核分枝杆菌遵循既定的传染途径。结核分枝杆菌是由受感染的人通过咳嗽或打喷嚏在环境中传播的,从而导致细菌散布在环境中。细菌因此被雾化,然后被附近的个体不经意地吸入,促进细菌通过呼吸道迁移,最终在宿主肺泡中定居。在肺泡中,早期的先天免疫反应发生,驻留的巨噬细胞被招募到感染部位,在那里它们吞噬感染的细菌,然而,巨噬细胞不能有效地清除细菌池[4]。这一过程导致局部免疫反应,最终导致免疫细胞招募到感染部位,导致一种称为肉芽肿的特征性感染性结构的形成,该结构保护受感染的巨噬细胞免受免疫系统的进一步攻击[5]。
肉芽肿可以将感染细菌保存数十年,而每当发生免疫抑制情况时,宿主的免疫反应和攻击病原体之间的动态平衡就会被破坏。因此,艾滋病毒阳性的患者患感染性结核病的风险很高,通常在这两种病理之间建立了直接的联系。
在本案例中,小马患有浸润型肺结核,属于继发性肺结核,即为以往感染过结核分枝杆菌,其潜伏于体内,在这段时间因过度劳累,免疫力降低,导致结核分枝杆菌再次活跃,发展为继发性肺结核。
四、易感性
生活贫困、居住拥挤、营养不良等社会经济因素对易感性的影响在此不做赘述,以下从易感人群(宏观)和基因多态性(微观)两个层面对肺结核的易感性进行分别介绍。
1. 易感人群(宏观)
以下用表格对八种肺结核易感人群进行总结(表2)。
表2 肺结核主要易感人群
| 婴幼儿和老年人 | 机体免疫力低,易患肺结核。 |
| 艾滋病患者 | 免疫力极低甚至丧失,易患肺结核。 |
| 糖尿病等慢性病患者 | 糖尿病患者体内的高糖环境有利于结核分枝杆菌的生长繁殖,晚期病人由于营养不良、抵抗力降低,更易患肺结核。 |
| 胃切除者 | 胃切除术后会导致消化吸收功能障碍,最终引起营养不良,抵抗力降低,结核分枝杆菌菌易乘虚而入。 |
| 长期应用激素类药物者 | 长期应用肾上腺皮质激素类药物,使机体抗感染能力降低。 |
| 未接种卡介苗者 | 不接种卡介苗,体内缺乏抵御结核分枝杆菌的抗体,易患肺结核。 |
| 肺结核患者接触密切者 | 特别是在封闭环境,空气不流通,结核分枝杆菌更易传播。 |
| 长期压力较大者(如在校学生、高强度工作者) | 长期压力较大,可能影响饮食、体育锻炼和睡眠等,引起免疫力下降,易患肺结核。 |
2. 基因多态性(微观)[6]
In addition to environmental, pathogen, and socioeconomic factors, host genetic diversity plays nonnegligible role in the initiation of TB. Candidate gene studies and genome-wide association studies (GWAS) have revealed many genetic polymorphisms related to the occurrence and prognosis of TB.
Researches on genetic variants that confer susceptibility to TB had indicated that the genetic components determining susceptibility are assigned by several small predisposing genes rather than a single major type. To date, abundant research studies have identified and explored the specific genes susceptible to TB, which are divided into two categories: HLA genes and non-HLA genes.
(1)HLA Genes
Human leukocyte antigens (HLAs) are the most complex genetic polymorphism system known to humans. The HLA gene is located on the short arm of the 6th chromosome, is about 4000 kilobases (kb) in length, contains 224 loci, and encodes a series of complicated markers on the surface of the cell membrane.
The HLA gene complex is distributed into three regions:
| HLA | HLA-1 | The HLA-I gene is located in the telomere end of the chromosome and is divided into -A, -B, and -C genes. HLA-I molecules combining with endogenous antigens are displayed on the cell surface and are recognized by CD8+T cells. |
| HLA-2 | The HLA-II gene is close to the centromere, mainly including DQ, DR, and DP subregions. HLA-II molecules bind and then present exogenous antigens to the CD4+T cell. | |
| HLA-3 | The HLA-III gene is located between the HLA-I gene and the HLA-II gene. HLA-III molecules do not participate in the antigen presentation except that a minority of them can participate in the immune regulation through the complement pathway. |
In general, it can be concluded that HLA-I and HLA-II genes are mainly responsible for antigen presentation and regulation of immune responses, which plays an important role in individual susceptibility to disease[7].
A great number of studies have explored the relationship between HLA genes and TB susceptibility, which is summarized in Table 3. Researches on the association between polymorphisms of HLA genes and TB in different populations have found that because of HLA loci polymorphisms, the linkage disequilibrium of genetic loci and their complex relationships with cytokines, it was impossible to draw unanimous conclusions among different ethnic groups, and it was also an arduous task to explain the association of HLA loci with diseases. And recent studies have focused on non-HLA genes[8].
(2)Non-HLA Genes
①VDR Gene
Epidemiological studies have shown that vitamin D deficiency is associated with susceptibility to TB. Vitamin D works through the vitamin D receptor(VDR). The VDR gene has an important effect on both congenital and acquired immunity; bacteria entering the lungs are engulfed by macrophages; VDR and its activated form,1,25-dihydroxy vitamin D3, directly stimulate induction of cathelicidin through the vitamin D-dependent pathway, killing intracellular MTB; and 1,25-dihydroxy-vitamin D3 can also induce human monocyte autophagy through antimicrobial peptides, then exert various immune regulation effects, but its role in acquired immunity is still controversial.
A large number of studies have shown that VDR polymorphisms are associated with susceptibility to TB, but only in Asian populations. The results of association studies between VDR gene polymorphisms and susceptibility of TB are inconsistent with different regional differences.
②SLC11A1 Gene
The solute carrier family 11 member 1(SLC11A1)/natural resistance-associated macrophage protein 1 (NRAMP1), initially found in mice, is a crucial determinant susceptible gene of TB in mice and is also the most widely studied candidate gene for TB susceptibility in non-HLA genes. After macrophage activation, NRAMP1 can transport divalent captions through the phagocytic membrane, thereby affecting the growth of MTB in phagosome.
There are series of findings indicating that the poly-morphisms of the SLC11A1 gene are associated with the susceptibility of TB in different populations. Studies have confirmed that 118 allele (GT) 9 in the promoter region can lead to the high expression of the SLC11A1 gene and to building immunity against TB, whereas 120 allele(GT) 10 has weaker promoter activity and less obvious susceptibility to TB[9]. Inversely, research has also been carried out on the 3′ untranslated region (3′UTR) of the SLC11A1 gene in West African, Asian, and South African populations, indicating that the SLC11A1 3′UTR mutation can significantly increase the risk of TB.
③TLR Gene
The Toll-like receptor (TLR) family belongs to pattern recognition receptors that are capable of identifying various pathogens, which plays an important role in early immune recognition and inflammatory response, and is of great significance to innate and adaptive immune responses. The relevance between the TLR gene and TB susceptibility is summarized in Table 4 . These data indicate that TLR polymorphism is significantly associated with susceptibility to TB and seems to be of high diversity among different ethnic groups.
④P2X7 Gene
The P2X7 receptor is a cationic channel presenting on the surface of blood cells and immune system cells and is especially highly expressed in the surface of macrophages. The P2X7 receptor can be activated by extracellular ATP, causing specific cationic channels to open, leading to Ca2+ and Na+ influx and K+ outflow and ultimately to cell apoptosis or tubercle bacillus death.
At present, the most studied 1513A-C locus variant in the P2X7 gene has discrepant verdicts in different races and regions. Research in the Gambian population shows that the 1513 A-C (rs3751143) variation is not associated with TB susceptibility, while the study showed that the 762C locus has a significant protective association against TB[10]. A study on Southeast Asian refugees in Australia had found that 1513 SNP is not related to TB, but 762C-locus diversity is significantly correlated with pulmonary TB[11]. A recent study shows that rs1718119 was related to a reduced risk for all active TB and sputum smear-positive cases in the Chinese Han population, and rs7958311 may contribute to a successful treatment outcome[12].
⑤Cytokines and Chemokines
Immune response is regulated by the interaction of lymphocytes, antigen presenting cells, and cytokines secreted by these cells. A growing number of studies have proved that gene polymorphisms in the promoter region or cytokine gene coding region are the host factors affecting susceptibility of TB.
Chemokine, a kind of protein with low molecular weight which guides white blood cells to specific sites of infection, plays a crucial role in combating MTB infection. When an organism gets infected, MTB induces macrophages to produce excess CC-chemokines (including MCP-1, CCL2, MIP-1α, CCL3, and CCL4) and is associated with the expression and secretion of active T cells (CCL5) as well as the regulation of CXC chemokine subfamily members. The associations of cytokines and chemokines with TB susceptibility are summarized in Table 5.
⑥Other genes
There are many other gene polymorphisms associated with TB susceptibility, such as CD209 gene, SP110 gene, NOS2A gene, MBL gene and so on.
(3)Host Genes with TB in Genome-Wide Association Studies (GWAS)
Genome-wide Association study refers to the screening of disease-related SNPs by identifying sequence variations, namely single nucleotide polymorphisms (SNPs), within the whole human Genome. However, results across candidate genes and GWAS are largely inconsistent. To date, several GWAS studies have found some host genes.
Taken together, these studies supported that host genes play an important role for mediating host regulation of MTB infection. The susceptibility of TB is correlated with various genes in multiple loci, and every single gene plays a certain unique role. But most effects in different subjects are inconsistent, which may be influenced by a variety of factors, the diverse source of cases, for example, and the different criteria for inclusion in the case group and the control group.
五、传染途径
1. 呼吸道
结核病在人群中的传染源主要是结核病病人,即痰直接涂片阳性者,主要通过咳嗽、喷嚏、大笑、大声谈话等方式把含有结核分枝杆菌的微滴排到空气中而传播,从呼吸道排出含有结核菌的微滴核,也就是飞沫,悬浮在空气中,如被周围的密切接触者吸入,特别是颗粒直径在4微米以下的微滴核,更容易被吸入,而引起肺泡感染。
飞沫传播是肺结核最重要的传播途径,经消化道和皮肤等其他途径传播现已罕见。传染性的大小除取决于病人排出结核分枝杆菌量的多少外,还与空间含结核分枝杆菌微滴的密度及通风情况、接触的密切程度和时间长短以及个体免疫力的状况有关。通风换气,减少空间微滴的密度是减少肺结核传播的有效措施。当然,减少空间微滴数量最根本的方法是治愈结核病病人。
2. 消化道
当食入被结核菌传染的食物时,结核菌在消化道大多数被胃酸等消化道杀死或随粪便排出,但在大量或反复多次食入结核菌时,结核菌可通过消化道进入肠道壁淋巴滤泡形成病灶。
3. 皮肤感染
正常情况下皮肤有抵抗外来细菌的能力,但当皮肤有破损等情况下,结核菌可以经皮肤侵入而形成感染病灶。
4. 胎盘感染
当母亲患有活动性结核病时胎儿在子宫内即可通过胎盘而受到结核菌的感染。但这种情况非常少见。
六、病理变化[13]
1. 基本病理变化
结核病的基本病理变化是炎性渗出、增生和干酪样坏死。结核病的病理过程特点是破坏与修复常同时进行,故上述三种病理变化多同时存在,也可以某一种变化为主,而且可相互转化。渗出为主的病变主要出现在结核性炎症初期阶段或病变恶化复发时,可表现为局部中性粒细胞浸润,继之由巨噬细胞及淋巴细胞取代。增生为主的病变表现为典型的结核结节,直径约为0.1mm,数个融合后肉眼能见到,由淋巴细胞、上皮样细胞、朗汉斯细胞以及成纤维细胞组成。结核结节的中间可出现干酪样坏死。大量上皮样细胞互相聚集融合形成的多核巨细胞称为朗汉斯巨细胞。增生为主的病变发生在机体抵抗力较强、病变恢复阶段。干酪样坏死为主的病变多发生在结核分枝杆菌毒力强、感染菌量多、机体超敏反应增强、抵抗力低下的情况。干酪坏死病变镜检为红染、无结构的颗粒状物,含脂质多,肉眼观察呈淡黄色,状似奶酪,故称干酪样坏死。
2. 病理变化转归
抗结核化学治疗问世前,结核病的病理转归特点为吸收愈合十分缓慢、多反复恶化和播散。采用化学治疗后,早期渗出性病变可完全吸收消失或仅留下少许纤维条索。一些增生病变或较小的干酪样病变在化学治疗下也可吸收缩小逐渐纤维化,或纤维组织增生将病变包围,形成散在的小硬结灶。未经化学治疗的干酪样坏死病变常发生液化或形成空洞,含有大量结核分枝杆菌的液化物可经支气管播散到对侧肺或同侧肺其他部位引起新病灶。经化疗后,干酪样病变中的大量结核分枝杆菌被杀死,病变逐渐吸收缩小或形成钙化。
七、临床症状
1. 咯血
咯血是指喉部以下的呼吸器官(即气管、支气管或肺组织)出血,并经咳嗽动作从口腔排出的过程。咯血是呼吸科急症,但咯血与上呼吸道出血、消化道出血,三者血液均从口腔流出,但三者的治疗方法不同,故在开始治疗前应迅速判明出血部位,以免延误治疗时机。上呼吸道出血者多有鼻出血史,当擤鼻涕时擤出血液,为鼻出血;闭嘴用鼻深吸气后再做咳嗽动作,可以咯出血液为鼻出血;鼻和咽喉部多有异物感、不适或疼痛;直视或镜检可见鼻或咽部有溢血点、血液、破溃或糜烂。咯血与呕血的鉴别诊断详见表6。

表6 咯血与呕血的鉴别
(1)病因[14]
咯血的病因多达100余种。最常见的(占90%)可分为四大类。
①感染性疾病
如肺结核、支气管炎、支气管扩张症、肺炎(肺脓肿)、肺部真菌病,血液多来自病变区域的扩张的支气管动脉或Ramussen's动脉瘤,或因干酪(结核)病变坏死、溶解而蚀破血管。
②支气管肺癌
③心血管疾病
如风湿性心脏病、肺栓塞、肺静动脉瘘、高血压病等。二尖瓣狭窄患者咯血的原因主要为肺动脉高压,而肺栓塞患者往往直接原因为肺动静脉和支气管动脉的损伤而出血。
④其他全身性疾病
如血液病凝血功能障碍、尿毒症、流行性出血热、肺出血肾炎综合征、替代月经等。
(2)肺结核咯血的发病机制[15]
①感染因素
肺结核疾病及其相关的继发性病毒感染,或者大量的致敏物质等都将导致患者出现炎症,从而导致肺部毛细血管的通透性大大增加,使得外部血细胞深入到肺泡中,导致咯血。
②肺毛细血管的渗透性增强,支气管砧膜破损
肺结核病将严重破坏患者的肺部结构,从而引发支气管扩张症状,且常伴有支气管的循环血管发生扭曲扩张,使侧支循环数量增加,导致肺与支气管循环之间的吻合度大大增加,造成支气管壁勃膜遭到破坏,出现溃疡、糜烂或肉芽组织被破坏等,从而导致咯血。
③空洞内动脉瘤被破坏
部分空洞型的肺结核患者由于内动脉瘤被破坏,容易导致咯血。
④钙石刺破血管
部分患者由于支气管、气管或肺部病变等原因,使支气管壁刺破或血管壁孔洞等。
⑤血液因素
血液方面的因素也是造成咯血的主要病因之一。主要是由于患者自身的溶血或凝血功能障碍,采用了氨硫脉等药物进行治疗导致血小板数量减少,或患者自身存在肝功能障碍阻碍了凝血酶原的生成等。
⑥心血管因素
患者自身的左心功能障碍或者存在血管栓塞等症状都会导致咯血。
(3)咯血的治疗

以下用思维导图对咯血的治疗进行总结(图9)。
图9 咯血的治疗15
2. 其他呼吸系统症状
咳嗽、咳痰两周以上或痰中带血是肺结核的常见可疑症状。咳嗽较轻,干咳或少量黏液痰。有空洞形成时,痰量增多,若合并其他细菌感染,痰可呈脓性。若合并支气管结核,表现为刺激性咳嗽。结核病灶累及胸膜时可表现胸痛,为胸膜性胸痛。随呼吸运动和咳嗽加重。呼吸困难多见于干酪样肺炎和大量胸腔积液病人。
3. 全身症状
发热为最常见症状,多为长期午后潮热,即下午或傍晚开始升高,翌晨降至正常。部分病人有倦怠乏力、盜汗、食欲减退和体重减轻等。育龄期女性病人可以有月经不调[16]。
(1)发热
肺结核病患者体内由结核杆菌及其菌体物质引起的变态免疫反应,可刺激引起白细胞介素-2的释放和增多,作为内生性致热原,白细胞介素-2作用于神经中枢的体温中枢而引起发热。
肺结核病引起的发热的体温和热型有不同的表现方式,主要与肺结核病的病情和病理形态、以及疾病的发展阶段有关。病情相对较轻的患者一般可只表现为低热,体温在38°C左右, 一般不高于 38.5C,主要在午后、傍晚或劳累后出现。病情重的患者特别是疾病进展期的患者往往表现为中、高度的发热,体温一-般在38.5"C以 上,有时可达40°C以上。热型无明显规律性,有时呈弛张热,有的表现为稽留热。粟粒型肺结核、浸润型肺结核急性进展期以渗出或变质坏死为主要病理改变的肺结核患者以及干酪性肺炎时的肺结核患者可为高热,体温在39°C以上,有时>41C,热型可为稽留热型。
(2)盗汗
盗汗是结核病中毒症状之一,是由于结核菌的毒素及其代谢产物刺激中枢神经系统,导致自主神经系统功能紊乱的结果。
4. 体征
多寡不一,取决于病变性质和范围。病变范围较小时,可以没有任何体征;渗出性病变范围较大或干酪样坏死时,则可以有肺实变体征,如触觉语颤增强、叩诊独音听诊闻及支气管呼吸音和细湿锣音。较大的空洞性病变听诊也可以闻及支气管呼吸音。当有较大范围的纤维条索形成时,气管向患侧移位,患侧胸廓塌陷、叩诊浊音、听诊呼吸音减弱并可闻及湿哕音。结核性胸膜炎时有胸腔积液体征:气管向健侧移位,患侧胸廓望诊饱满、触觉语颤减弱、叩诊实音、听诊呼吸音消失。支气管结核可有局限性哮鸣音。
少数病人可以有类似风湿热样表现,称为结核性风湿症。多见于青少年女性。常累及四肢大关节,在受累关节附近可见结节性红斑或环形红斑,间歇出现。
八、检查诊断
1. 查体
(1)叩诊
①方法与顺序
叩诊时病人宜采取坐位或仰位。解开衣服,肌肉放松,呼吸均匀。检查前胸时,胸部前挺;检查背部时,病人头向前略垂,躯干稍向前弯,两肩自然下垂,两手置于膝上,必要时两手抱对侧肩部或肘部,以使背部平坦。叩诊顺序应先胸后背,自上而下,左右对比,即由肺尖部向下,沿肋间由前向后进行叩诊,注意辨别轻微叩诊音的变化。
②正常叩诊音
正常肺部叩诊音为清音,肺组织复盖心脏,肝脏实质脏器部位的叩诊音为浊音。左下胸部,因正常的肺组织与含气的胃泡相重叠,所以叩诊时有一鼓音区。
③异常叩诊音
异常叩诊音的程度取决于病变的大小,部位及性质。深部的病灶(离胸壁表面5cm以上)、小范围病灶(小于3cm)或少量胸腔积液(250ml以下),常不能发现叩诊音变化;散在疏松的病灶可引起轻度浊音;大面积致密度高且接近胸壁表面者可出现明显浊音;大量胸腔积液则为实音。
(2)触诊(语颤)
触诊检查语音震颤(Vocal tactile fremitus)是一种重要的检查方法。病人发出声音,音波产生的震动,沿着气管、支气管及肺泡,传到胸壁引起共鸣的震动,医生可以用手触知,称为语音震颤。
①方法
医生两手掌或尺侧量缘轻贴在病人胸壁两侧对称部位,但不可用力压在胸壁上,以免减弱手掌的敏感性。让病人拉长声说一或“啊”,可以感到一种颤动的感觉,两手交替对比检查两侧是否相同,注意有无单侧、双侧或局部的增强减弱或消失(图11)。
②影响因素
语颤的传导与气管及支气管通畅与否,肺含气量多少,胸膜壁层及脏层是否相贴近,发音的强弱与语调高低,距音源的远近及胸壁的厚薄等有密切关系。
(3)细湿罗音
①原因
湿啰音,系由于吸气时气体通过呼吸道内的稀薄分泌物所产生的声音,故又称水泡音。
肺部局限性湿啰音,仅提示该处的局部病变,如肺炎、肺结核或支气管扩张等;两侧肺底湿啰音,多见于心力衰竭所致的肺瘀血和支气管肺炎等;如两肺野满布湿啰音,则多见于急性肺水肿或严重支气管肺炎。
②诊断
听诊特点为断续而短暂,一次常连续多个出现,以吸气时或吸气终末较为明显,有时也出现于呼气早期。部位较恒定,性质不易变,中、小湿啰音可同时存在,咳嗽后可减轻或消失。
2. 血沉
(1)概念
将抗凝血放入血沉管中垂直静置,红细胞由于密度较大而下沉。通常以红细胞在第一小时末下沉的距离表示红细胞的沉降速度,称为红细胞沉降率,即血沉。血沉速度的快慢与血浆黏度,尤其与红细胞间的聚集力有关系。红细胞间的聚集力大,血沉就快,反之就慢。
(2)检查方法
采静脉血压计1.6亳升,注入含有3.8%枸椽酸钠溶液化豪升的试管内,混匀。
(3)病理意义
增快:急性炎症、结缔组织病、严重贫血、恶性肿瘤、结核病等;
减慢:红细胞增多症、脱水等。
(4)临床应用
①观察结核病和风湿热的病情变化和疗效:血沉的快慢还可辅助观察病情的变化。如风湿病、结核病血沉加快的程度常与病情轻重有关。活动期血沉加快;病情好转时血沉速度减缓;非活动期血沉可以恢复到参考范围。因此,测定血沉可大致推测疾病的发展及观察治疗效果。
②某些疾病的鉴别诊断:如心肌梗死和心绞痛,胃癌和胃溃疡,盆腔癌性包块和无并发症的卵巢囊肿等的鉴别,都是前者血沉明显增快,后者正常或略有增高。
③多发性骨髓瘤病人,血浆中出现大量异常球蛋白,血沉加快非常显著,血沉可作为重要诊断指标之一。
④判断血沉结果的正常与否需按性别区分,参考范围(魏氏法) 男性为0~15mm/1小时,女性为0~20mm/1小时。血沉可因生理因素而加快,如女性在月经期间和妊娠期间可达到40毫米左右,小儿及50岁以上的老人血沉可略快于参考范围,此时可能与疾病无关。
3. 痰抗酸杆菌染色[17]
(1)原理
分枝杆菌的细胞壁内含有大量的脂质,包围在肽聚糖的外面,所以分枝杆菌一般不易着色,要经过加热和延长染色时间来促使其着色。但分枝杆菌中的分枝菌酸与染料结合后,就很难被酸性脱色剂脱色,故名抗酸染色。
(2)目的、优势与检查对象
在结核病控制工作中,通过实验室细菌学检查诊断传染性肺结核是DOTS策略的重要要素之一,痰结核菌检查对于发现传染源、确定诊断和化疗方案、考核疗效、评价防治效果具有重要意义。因此,结核病细菌学检查是国家结核病防治规划(NationalTuberculosisProgramme,NTP)的重要组成部分,在现代结核病控制工作中起着不可缺少的重要作用。
(3)萋尔-尼尔逊染色显微镜检查法(Ziehl-Neelson,简称萋尼染色法)
萋尼染色法是在加热条件下使分枝菌酸与石炭酸复红牢固结合成复合物,用盐酸酒精处理也不脱色。当再加碱性美兰复染后,分枝杆菌仍然为红色,而其他细菌及背景中的物质为蓝色。
涂片制备、染色和显微镜检查的方法步骤详见《中国结核病防治规划痰涂片镜检质量保证手册》18,这里详细介绍镜检结果分级报告标准:
- 抗酸杆菌阴性:连续观察300个不同视野,未发现抗酸杆菌。
- 抗酸杆菌阳性(报告抗酸杆菌菌数):1~8条/300视野。
- 抗酸杆菌阳性(1+):3~9条/100视野,连续观察300个视野;
- 抗酸杆菌阳性(2+):1~9条/10视野,连续观察100个视野;
- 抗酸杆菌阳性(3+):1~9条/1视野;
- 抗酸杆菌阳性(4+):≥10条/1视野。
注:报告1+时至少观察300个视野,报告2+至少观察100个视野,3+、4+时至少观察50个视
野。
(4)荧光染色显微镜检查法
涂片制备、染色和显微镜检查的方法步骤详见《中国结核病防治规划痰涂片镜检质量保证手册》18,这里详细介绍镜检结果分级报告标准:
- 荧光染色抗酸杆菌阴性(-):0条/50视野;
- 荧光染色抗酸杆菌阳性(报告抗酸菌数):1~9条/50视野;
- 荧光染色抗酸杆菌阳性(1+):10~49条/50视野;
- 荧光染色抗酸杆菌阳性(2+):1~9条抗酸菌/1视野;
- 荧光染色抗酸杆菌阳性(3+):10~99条抗酸菌/1视野;
- 荧光染色抗酸杆菌阳性(4+):100条及以上抗酸菌/1视野。
注:报告2+至少观察50个视野,3+及以上的阳性结果至少观察20个视野。
4. 结核菌素试验[18]
(1)用途
结核菌素试验可用于婴幼儿的结核病诊断、卡介苗接种效果测定和结核分枝杆菌感染的流行病学调查,还可用于肿瘤病人细胞免疫功能测定。
(2)原理
人感染结核分枝杆菌后,产生免疫力的同时也会发生迟发型超敏反应。结核菌素皮肤试验(tuberculinskintest,TST)就是根据这一原理设计而成。
目前该试验采用的结核菌素为纯蛋白衍生物(purifiedproteinderivative,PPD),是由旧结核菌素(oldtuberculin,OT,为含有结核分枝杆菌的甘油肉汤培养物加热过滤液,主要成分是结核蛋白)经三氯醋酸沉淀后的纯化物;PPD有两种,即PPDC和BCGPPD,分别由结核分枝杆菌和卡介苗提取,因此TST也称为PPD试验。
(3)方法
取5单位PPD注入受试者左前臂掌侧前1/3中央皮内,72小时(48~96小时)后查验,注射部位红肿硬结直径<5mm或无反应者为阴性;≥5mm者为阳性;≥15mm者或局部出现双圈、水泡、坏死及淋巴管炎者为强阳性。
(4)结果
阳性反应表明卡介苗接种成功,或未接种卡介苗和非结核分枝杆菌流行地区结核分枝杆菌感染。强阳性反应则表明可能有活动性结核病,尤其是婴儿。
需要注意的是,在原发感染早期、患严重的结核病或患其他严重疾病致细胞免疫功能低下者(如艾滋病病人、肿瘤病人或用过免疫抑制剂者),可能出现阴性反应。
5. 其他检测方法
(1)分离培养
将待检样品经浓缩集菌后,接种于改良罗氏固体培养基,培养基所含的孔雀绿可抑制杂菌生长,37C培养4~8周直至可见菌落生长。依据生长速度和菌落特点,可初步判定为结核分枝杆菌,再进一步用染色法和生化反应证实。
BacterTB-460系统是结核分枝杆菌快速培养系统:在结核分枝杆菌专用培养基中加入含有14C的棕榈酸底物,样品接种后,如有结核分枝杆菌生长繁殖,14C棕榈酸降解后产生带有放射性的14CO2,经仪器检测显示结果。该法敏感性较常规法高10%左右,检出时间缩短到2~3周。
(2)动物试验
常用豚鼠或地鼠鉴别疑似结核分枝杆菌的分离培养物以及进行毒力测定。取经浓缩集菌处理的样本1ml注射于豚鼠或地鼠腹股沟皮下,经3~4周饲养观察,如出现局部淋巴结肿大,消瘦或结核菌素试验阳性;可及时剖检;若观察6~8周后仍未见发病者,也要剖检。剖检时应注意观察淋巴结、肝、脾肾等脏器有无结核病变,并可进行涂片染色镜检或分离培养鉴定。
(3)药物敏感试验
结核分枝杆菌耐药性的自发突变率较高,临床上耐药菌株流行广泛。美国CDC推荐对所有病人的分离菌株进行药敏性试验,以便对化疗作出预期的效果评价。对涂片阳性病人的治疗持续3周以后,痰涂片仍为阳性者,需重复药敏试验。
(4)基因检测
基因检测快速标准化高通量,且对实验室生物安全要求较低。PCR检测结核分枝杆菌DNA的.灵敏度高,每毫升检材中含有10~100个活菌即可检出,因此可用于结核病的早期快速诊断。结核分枝杆菌耐药与基因突变密切相关,分子(基因型)诊断技术有助于耐药结核病检测。WHO推荐使用XperMTB/RIF试验进行结核病快速诊断,该方法以全自动半巢氏实时PCR技术为基础,以rpoB基因为靶基因,可在2小时内同时检测结核分枝杆菌和利福平耐药。此外,分枝杆菌16SrRNA高变异区序列测定、限制性长度多态性分析(RELP)等分子生物学技术已成功用于分枝杆菌的鉴定。
(5)IFN-γ释放试验
结核分枝杆菌感染后,体内存在抗原特异性的记忆性T细胞,当再次遇到抗原刺激时,能迅速活化增殖,产生多种细胞因子,其中IFN-是关键的细胞因子。IFN-Y释放试验(inteferon-gamma release asay,IGRA)是一种用于结核病体外免疫检测的新方法。该方法是以结核分枝杆菌与卡介苗的差异蛋白ESAT-6和CFP-10多肽刺激致敏的T淋巴细胞分泌IFN-y,通过酶联免疫斑点试验(enzyme linked immunospot assay,ELISPOT)进行检测,1~2天即可获得结果,具有敏感度和特异度高的优点。IGRA对鉴别潜伏结核病感染与卡介苗接种后反应和非结核分枝杆菌感染有重要价值,并可用于结核病尤其是肺外结核病的辅助诊断,但该技术操作要求高,试剂盒价格昂贵。
(6)抗体检测
结核分枝杆菌感染后产生多种抗体。用ELISA检测病人血清中特异性抗体,目前已有几种试剂盒在临床使用,但仍需进一步提高其敏感性和特异性。
九、预防
1. 卡介苗
(1)原理介绍
卡介苗(Bacillus Calmette一Guerin,BCG)是由减毒牛型结核杆菌悬浮液制成的活菌苗,是一种非特异性免疫增强剂,可增强巨噬细胞的吞噬活性,活化淋巴细胞,提高机体细胞免疫和体液免疫水平,是一种常用的免疫增强剂。
BCG能够编码4000多种蛋白,抗原谱丰富,接种后可在机体内引起丰富的免疫应答反应。研究显示,疫苗接种1~3d后,BCG可诱导接种部位的固有免疫细胞在接种部位产生局部炎性细胞因子,如白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)等,并可招募单核细胞到达接种部位;9d后,局部浸润的单核细胞成为炎性因子的主要来源。BCG的病原相关分子模式(pathogen associated molecular pattern, PAMP),如肽聚糖、阿拉伯半乳聚糖和霉菌酸等,存在于BCG菌株的细胞壁中,可通过与固有免疫细胞表面的病原识别受体(pathogen recognition receptor,PRR)如补体受体、Toll样受体(TLR)-2和TLR-4等作用而启动免疫应答。随后,疫苗接种部位的树突状细胞携带BCG抗原进入淋巴结,向初始T细胞递呈BCG抗原,启动适应性免疫应答。
此外,被吞噬进入单核-巨噬细胞内的BCG还可通过细胞内模式识别受体——核苷酸结合寡聚化结构域蛋白2(nucleotide-binding oligomerization domain-2,NOD2)受体介导的信号通路使其发生表观遗传修饰,最终导致细胞功能的改变。BCG主要诱导人体内产生辅助性T细胞1(Th1)。同时树突状细胞发挥其抗原交叉呈递功能,引起CD8+T淋巴细胞免疫应答。虽然目前普遍认为BCG引发的免疫应答以细胞免疫为主,但BCG接种者血清中可以检测到MTB脂阿拉伯甘露聚糖(LAM)特异性IgG水平显著增加,且LAM的糖成分——阿拉伯甘露糖(AM)的单克隆抗体在研究中显示出保护作用,因此推测体液免疫也可能在BCG诱导的免疫保护中同样具有一定的意义[19]。
姜燕等[20]研究了卡介苗素对36例扁平疵的疗效以及对患者细胞免疫功能的影响,结果发现,卡介苗素组治疗之后外周血CD4水平以及CD4/CD8比值较治疗前显著升高,CD8水平下降,证明卡介苗素可调节患者细胞免疫功能。
但是,卡介苗中成分复杂,使用时,尤其做注射用有一定的毒副作用,应特别注意。
(2)毒副作用
①治疗用卡介苗在使用后可能发生“卡介苗全身性反应”,临床症状包括:发热39.5℃或39.5℃以上,持续12小时或12小时以上;发热38.5℃或38.5℃以上,持续48小时或48小时以上;肺炎、肝炎、外泌尿生殖器官机能异常,有活体组织检查的肉芽肿性炎症;或败血症的传统症状,包括循环不良,急性呼吸困难和散在的血管内血凝。
②治疗用卡介苗在使用后可能引起局部反应。灌注后,膀胱受药液刺激可出现尿频、尿急、血尿、排尿困难等症状。
③治疗用卡介苗在使用后可能出现低热。常在用药2~3小时出现,持续数天不等。不需停药,也不需治疗,能自愈。发生率较高,常有半数以上的患者可发生这类症状。
④有少数患者使用治疗用卡介苗后可自觉不适乏力,关节疼痛,体温达38℃以上。还有个别患者由于卡介菌侵入局部组织,细菌生长繁殖,引起尿道炎、前列腺炎、睾丸炎或附睾炎。
⑤极个别患者,因卡介菌经血液引起卡介苗性肺炎或肝炎。凡出现全身性反应的患者,均应立即停止用药,并用抗痨药,对症药等进行治疗。
2. 预防措施

以下用思维导图对预防措施进行总结(图17)。
图17 肺结核的预防措施[21]
十、治疗
1. 治疗用药

以下是对抗结核的一线和二线药物及其作用原理、不良反应的总结(图18)。
图18 抗结核的一线和二线药物及其作用原理、不良反应[22]
2. 治疗方案
(1)推荐药物治疗方案
①初治肺结核:2HRZE/4HR或2H3R3Z3E3/4H3R3。
②复治肺结核:2HRZES/6HRE或2H3R3Z3E3S3/6H3R3E3或3HRZE/6HRE。有药敏试验结果患者可根据药敏试验结果以及既往用药史制订治疗方案。如果患者为多次治疗或治疗失败病例,可根据患者既往治疗史制订经验性治疗方案,获得药敏试验结果后及时调整治疗方案。
③耐多药肺结核:6ZAm(Km,Cm)Lfx(Mfx)PAS(Cs,E)Pto/18ZLfx(Mfx)PAS(Cs,E)Pto(括号内为替代药物)。
H:异烟肼,R:利福平,Z:吡嗪酰胺,E:乙胺丁醇,Lfx:左氧氟沙星,Mfx:莫西沙星,Am:阿米卡星,Km:卡那霉素,Pto:丙硫异烟胺,PAS:对氨基水杨酸,Cm:卷曲霉素,Cs:环丝氨酸。
④对于病情严重或存在影响预后的合并症的患者,可适当延长疗程。
⑤特殊患者(如儿童、老年人、孕妇、使用免疫抑制以及发生药物不良反应等)可以在上述方案基础上调整药物剂量或药物。
(2)并发症
在进行化疗的同时,可针对患者的并发症或合并症进行治疗。
3. 耐药机制[23]
耐药结核病分为以下几种:
①单耐药结核病(mon-resistant tuberculosis,MR-TB):结核病患者感染的结核分枝杆菌(myco-bacteria tuberculosis,MTB)经体外药物敏感性试验(drug susceptibility testing,DST)证实仅对1种一线抗结核药物耐药。
②多耐药结核病(poly—resistant tuberculosis,PDR-TB):结核病患者感染的MTB经体外DST证实对1种以上一线抗结核药物耐药(但不包括同时对异烟肼和利福平耐药)。
③耐多药结核病(multidrug—resistant tuberculosis,MDR-TB):结核病患者感染的MTB经体外DST证实至少同时对异烟肼和利福平耐药。
④准广泛耐药结核病(Pre—XDR—TB):结核病患者感染的MTB经体外DST证实在耐多药的基础上对1种氟喹诺酮类或1种二线注射类抗结核药物耐药。
⑤广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB):结核病患者感染的MTB经体外DST证实在耐多药的基础上至少同时对1种氟喹诺酮类和1种二线注射类抗结核药物耐药。
⑥利福平耐药结核病(rifampicin—resistant tuberculosis,RR-TB):结核病患者感染的MTB经体外DST证实对利福平耐药。
以下分类介绍MTB的耐药机制。
(1)细胞壁结构与组成(天然屏障)
分枝杆菌细胞壁上有选择性吸附阳离子的孔蛋白,能有效控制或阻滞亲水性小分子的扩散,大大降低了化合物的渗透性,导致药物进人高疏水性细胞壁间隙比较慢,这便筑成了MTB对药物的第一道防线;且MTB有相对的耐干燥、耐碱等特性,使得它很难被清除。MTB的细胞壁和其他细菌有着很大的差别,其中类脂质含量超过60%,而革兰阴性细菌类脂质含量仅占20%左右。类脂质是一类复杂的复合物,其赋予MTB表面疏水性,含有分枝菌酸(是MTB和棒状杆菌属独有的结构,主要由22~24碳短链和40~64长链分枝脂肪酸组成,使MTB免受溶菌酶、自由基等损伤,抵抗亲水性化合物或抗生素的攻击)。
①分枝菌酸(myolic acid)
是组成MTB细胞壁的关键成分,赋予了细菌极强的抵抗力。异烟肼对MTB产生作用的机制就是抑制了分枝菌酸的合成,破坏细菌的细胞壁,使其因失耐酸性和疏水性而死亡。
②阿拉伯半乳聚糖层
Alderwick等于2005年发现阿拉伯糖基转移酶(arabinofuranosyltransferase,AftA),是MTB细胞壁的主要成分,是阿拉伯聚糖生物合成途径中的关键酶,也是重要的MTB致病相关因子。阿拉伯半乳聚糖层能阻止疏水性分子的进入。乙胺丁醇是一种阿拉伯糖类似物,其通过抑制阿拉伯半乳聚糖层的合成进而达到杀菌效果。
③细胞壁黏肽
细胞壁的主要结构成分为细胞壁黏肽,由N一乙酰葡萄糖胺(GNAc)和与五肽相连的N-乙酰胞壁酸(MNAc)重复交替联结而成,而环丝氨酸(cycloserine,Cs)可通过抑制黏肽生物合成酶D丙氨酸的消旋酶(Ar)和合成酶(Dd),而阻碍细胞质内黏肽前体N-乙酰胞壁酸的形成,抑制细菌细胞壁黏肽(肽聚糖)的合成,致MTB细胞壁缺损,减弱其耐酸能力,有杀菌和抑菌作用。
(2)编码基因突变
MTB耐药性的产生多由其基因组上编码药物标靶的基因或与药物活性有关的酶的基因突变所造成,即基因型耐药。基因型耐药的基础是在大量MTB群中存在天然抗药突变株,这些突变株在药物的选择压力下保留并繁殖。基因型耐药的菌株能够将耐药特性传递给后代菌株,后代菌株能保持并遗传其耐药性。
(3)编码基因突变
在MTB中已经发现了活跃的药物外排泵系统,外排泵能将菌体内药物泵出,使得胞内药物浓度不能有效抑制或杀灭分枝杆菌,从而产生耐药性。目前为止,虽有MTB质粒的报道,但未发现质粒介导耐药的现象。仅凭MTB天然细胞壁屏障作用和耐药基因并不能全面解释其耐药机制,有些MTB虽然发生了突变却不耐药;有些耐药的MTB却没有发现突变基因,这说明MTB还有其他的耐药机制。研究表明,分枝杆菌存在药物主动外排泵的表达,并被视为是MTB药物靶分子突变机制外的一个重要机制。外排泵是膜上参与代谢的一些蛋白,它们认为抗生素是外来毒素而将其排出膜外。最早人们只是在肿瘤细胞及细菌中发现存在外排现象,并导致低浓度耐药的产生。虽然导致的是低浓度的耐药,但正是外排泵的出现增加了基因突变的频率,并最终导致高浓度耐药的产生。MTB外排泵的发现时间并不是很长,但却是对耐药机制研究的一个重要补充。
研究发现,分枝杆菌外排泵能将其细胞内的药物泵出,使得胞内药物浓度不能有效抑制分枝杆菌的生长,从而产生对抗生素的耐受性。药物外排系统根据其蛋白氨基酸同源性可分成很多种类,MTB的H37Rv株基因组有20个编码假想外排泵的开放阅读框(0RF)。目前,仅有几种分枝杆菌外排泵得到了一定研究,分别为属于主要易化超家族(MFS)的LfrA、Rvl634、EfpA、Rt(V)、P55、Bp、Rvl258c;属于耐受小节分裂区家族(RND)的MmpL;属于ATP结合超家族(ABC)的DrrAB、Pst、Rv2686c-Rv2687c-Rv2688c;属于小耐多药家族(SMR)的Mmr等。其中LfrA为分枝杆菌中被发现的第一个功能外排泵,具有较广的底物专一性。
(4)常用抗结核药物及其耐药机制
①异烟肼(IFN)
INH的作用机制是被MTB内的触酶——过氧化物酶施katG活化,抑制了烯酰基载体蛋白(enoyl—ACP)还原酶inhA,从而抑制分枝菌酸和细胞壁的生物合成,丧失多种能力如抗酸染色、增殖性和疏水性,最终导致死亡。对异烟肼耐药的MTB与多种基因突变有关,目前与INH耐药相关的突变基因有katG、inhA、sigl等,其中katG和inhA基因是主要耐药基因,二者占总耐药基因引起耐药的90%以上。
katG基因:分析发现导致异烟肼耐药性的原因主要包括托£G基因的插入、缺失,以及点突变。463位CGG—CTG、315位AGC—ACC是最常见的katG基因点突变,除此之外katG基因突变点还包括104、108、138及148位。katG基因突变破坏触酶——过氧化物酶的产生,从而使INH对MTB无法产生作用。
inhA基因:inhA基因是enoyl—ACP还原酶的编码基因。如果inhA基因出现结构突变,则会降低烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)和异烟肼的亲和力,进而出现耐药。inhA结构基因常见的突变位于16、21、47和178位密码子上;inhA基因启动子突变常见于碱基对的置换,如:24位(G→T),16位(A→G),或8位(T→G);除此之外inhA基因的调节序列发生突变或者inhA基因中的某一点发生突变,则会导致inhA基因蛋白过度表达,从而导致异烟肼耐药。inhA基因的过度表达造成分枝菌酸的过度合成,而katG基因突变主要是由αhpC基因突变造成的。
②利福平(RFP)
RFP的作用机制是与MTB DNA依赖的RNA聚合酶β亚单位(rpoB)结合,从而抑制其活性,进而对mRNA转录进行抑制,干扰DNA及蛋白质的合成,导致细胞死亡。rpoB基因则是RNA聚合酶β亚基所依赖的编码基因,在位于RNA聚合酶β亚单位rpoB核心保守区域出现突变时,如缺失突变、插入突变或者点突变等,约97%对RFP耐药的MTB受RNA聚合酶β亚单位的rpoB基因突变影响,造成RFP与RNA聚合酶之间的亲和力减小,从而导致MTB对RFP产生耐药性。RNA聚合酶β亚单位rpoB核心保守区域的突变96%主要集中在一段81 bp的区域内,其中65%~86%的突变位于526或53l位密码子,并导致对RFP的高度耐药,临床上将检测这个区域的突变作为MTB对RFP耐药的参考,而511、516、518和522位密码子的突变与MTB对RFP低水平的耐药相关。
③乙胺丁醇(EMB)
EMB是一种阿拉伯糖类似物,作用于分枝杆菌阿拉伯糖基转移酶,使阿拉伯半乳聚糖和阿拉伯甘露聚糖合成障碍,MTB无法合成完整的细胞壁并造成分枝菌酸积累,导致细菌死亡。阿拉伯糖基转移酶的编码基因为embABC操纵子基因,其过量表达导致MTB对EMB产生耐药性。embABC操纵子基因是由embA、embB和embC等3个基因构成的复合物,耐EMB菌株的常见突变点为embB基因的306密码子。
④吡嗪酰胺(PZA)
PZA需经pncA基因编码的PZA酶催化才能变为活性形式,约72%~98%对PZA耐药的菌株存在pncA基因突变,使PZA酶失去活性从而抑制吡嗪酸的合成,最终导致菌株耐药。pncA基因位点突变呈高度多样性,但有3个密码子区域如3~17位、132~142位、61~85位有相当程度的聚集性。
⑤氟喹诺酮类药品
氟喹诺酮类药品的主要作用是抑制MTB脱氧核糖核酸DNA回旋酶,该酶由gyrA和gyrB基因编码。gyrA基因和gyrB基因突变主要集中在一个保守区域,此区域编码的是氟喹诺酮类药品与DNA回旋酶相互作用的位点。研究表明gyrA基因上单一的错义突变与MTB对氟喹诺酮类药品低水平耐药有关,而高水平耐药一般在gyrA基因上发生2个或2个以上的错义突变,或者gyrA基因和gyrB基因同时产生突变。
4. 耐药结核病新药
随着现有药物耐药率的不断提高,针对MDR-TB的新药需求也越来越迫切。以下根据3类作用机制介绍几种临床上治疗MDR-TB的新化学实体:靶向细胞壁合成、靶向能量代谢以及靶向蛋白质合成。
(1)靶向细胞壁合成
抑制MTB细胞壁的生物合成是一个有效的抗结核药物开发策略,一线药物异烟肼和乙胺丁醇均是靶向细胞壁合成的过程。MTB的细胞壁由独特的内层和围绕质膜的外层组成,内层由肽聚糖(PG)、阿拉伯半乳聚糖(AG)和分枝菌酸(MA)构成,它们共价连接形成MA-AG-PG复合物。该复合物能够形成疏水的渗透性屏障,阻止许多环境溶剂进入,从而使MTB耐酸,并能够在极端恶劣的环境下生存,因此被认为是MTB细胞壁的核心结构,是抗MTB药物的重要靶标。
①德拉马尼(delamanid)
德拉马尼是大冢制药研发的一种硝基咪唑类杀菌药,它的作用机制为抑制分枝菌酸的合成。其于2014年获得欧盟委员会的上市批准,在患者对基本治疗药物耐药以及对其他治疗方案不耐受的情况下,该药可作为联合治疗方案的一部分,用于成人MDR-TB的治疗。
德拉马尼对H37Rv菌株的MIC为0.012μg/mL,在体内低剂量就有较高的抗结核活性。口服德拉马尼4~8h后达到药峰浓度,10~14d达到稳态,血浆半衰期为30~38h,大部分德拉马尼及其代谢产物通过粪便排泄。H37Rv菌株对德拉马尼的自发抗性频率为6.44×10-6-1.22×10-5,与异烟肼相当。德拉马尼对细胞色素酶P450(CYP450)无抑制或诱导作用,所以它能够与其他药物联用,包括一些会诱导CYP450酶或者由CYP450酶代谢的抗HIV药物。临床试验显示,接受每日两次的100mg德拉马尼联合优化的背景方案治疗2个月的患者,痰培养转阴的比例显著高于接受安慰剂组的比例(45.4%vs29.6%)。
②普托马尼(pretomanid)
普托马尼也是一种硝基咪唑类化合物,最初由Pathogenesis公司发现临床有效,其作用机制是抑制MTB蛋白质和霉菌酸的合成。2019年8月14日,FDA批准普托马尼与贝达喹啉和利奈唑胺联合使用来治疗XDR-TB以及对其他疗法不耐受或无响应的MDR-TB。与目前已有的抗结核药物不同,普托马尼对处于复制期和非复制期的MTB均有杀菌活性,其代谢过程中能够产生活性氮物质(如一氧化氮),是MTB的呼吸毒素,有助于对非复制期MTB的杀灭。
(2)靶向能量代谢
特雷贝克和贝达喹啉均靶向MTB的能量代谢过程,分别抑制细胞色素bc1和ATP合成酶,因而均能够降低MTB的ATP产量,但当细胞色素bc1复合体被抑制时,需氧生长期细胞色素bd氧化酶就会参与能量的供给。特雷贝克正是由于存在替代的细胞色素bd氧化酶,使其表现出了较贝达喹啉更弱的杀菌活性。
①贝达喹啉(bedaquiline)
贝达喹啉是美国强生公司研发的二芳基喹啉类药物,是40余年来第1个抗结核新药,它是分枝菌酸ATP合成酶抑制剂,而ATP合酶参与了MTB能量供应过程。2012年,FDA批准贝达喹啉用于MDR-TB的治疗。2013年,当对其他治疗方案耐药或不耐受时,WHO推荐贝达喹啉用于MDR-TB的治疗。
强生公司针对耻垢分枝杆菌的全细胞筛选得到了化合物4(图21),接下来对化合物4的构效关系探索包括:改变季碳中心连接的侧链长度;用不同的胺以及非碱性基团代替侧链末端的二甲氨基;在侧链的第1个苯环上引入吸电子和给电子基团;用烷基、芳基以及杂环取代侧链的第2个苯环;在喹啉环不同位置引入不同取代基;以及测试了不同的异构体,最终发现了贝达喹啉。
②特雷贝克(telacebec)
特雷贝克属于咪唑并吡啶酰胺类化合物,目前处于临床Ⅱ期研究,它通过与QcrB亚基结合抑制细胞色素bc1(电子传递链复合物Ⅲ)[24]。
特雷贝克的发现始于对多个商业化合物库的表型高内涵筛选,从121156个化合物中得到了106个有活性的苗头化合物,其中的IPA01对巨噬细胞内、外的MTB均有较好的活性(分别在1.25和1.86μmol/L浓度下,抑制率达到50%),对IPA01的吡啶环、咪唑的2位甲基以及咪唑的3位侧链进行结构衍生合成了477个化合物并进行了评估,最终得到特雷贝克(图6)[38]。它能够干扰缺氧非复制性MTB的ATP稳态,IC50小于10nmol/L,在低浓度下可以快速抑制ATP合成。它在0.0027μmol/L浓度下对MTBH37Rv菌株的抑制率为50%。在MTB的急性小鼠模型中,给药剂量为10mg/kg时,细菌负荷减少90%以上,而在慢性小鼠模型中,给药剂量分别为0.4,2以及10mg/kg时,在4周后细菌负荷均减少90%以上。此外,特雷贝克在小鼠急性毒性模型中显示出良好的药代动力学性质以及安全性。
(3)靶向能量代谢
噁唑烷酮类化合物是一类新的合成抗生素,其通过与23SrRNA结合,在翻译的早期阶段抑制细菌蛋白质的生物合成,从而导致其死亡。此外,亮氨酰-tRNA合成酶(LeuRS)在细胞翻译中起着重要作用,并且最近已被临床验证为新的抗菌靶标。
①舒特唑利德(sutezolid)
舒特唑利德是利奈唑胺的类似物,目前处于临床Ⅱ期研究中,作用机制是通过阻断翻译来抑制蛋白质的合成。其与现有的抗结核药物没有交叉耐药性,联合使用时可以显著增加杀菌活性,表明其具有缩短结核化疗时间的潜力。
②TBI-223
TBI-223也是一种新型噁唑烷酮类化合物,目前处于临床Ⅰ期,作用机制是抑制MTB蛋白质的合成。TBI-223对人类最主要的5种CYPs没有抑制作用,在人肝细胞中也没有CYP诱导作用。TBI-223在动物实验中表现出较好的药代动力学性质和安全性:在小鼠和大鼠体内均有较高的生物利用度,合理的表观分布容积,半衰期分别为3和8h;在狗体内有高的生物利用度,中等清除率[6.6mL/(min·kg)];在狗体内的14d毒性研究中,其无明显损害作用剂量达到了150mg/(kg·d);28d大鼠毒性研究中未观察到血液学变化或骨髓毒性。
5. 药用植物

以下是对抗结核的植物及其入药部位、药用成分和针对病菌的总结(图19)。
图19 抗结核的植物及其入药部位、药用成分和针对病菌23
6. 支持治疗[25]
(1)一般要求
保持病室整洁、安静,温、湿度适宜,被服干燥、清洁、床单平整。患者应绝对卧床休息,应平卧头偏向一侧,便于将血咳出。为防止窒息,绝对禁忌坐起咳嗽、咯血。注意体温、脉搏、呼吸、血压等变化,若持续高热、脉搏加快、呼吸急促,提示病情加重,应加强护理。
(2)密切观察病情
注意观察病人咳嗽、咳痰有无加重,痰量有无增多或呈脓性,是否痰中带血;有无高热,若有高热则考虑病情加重或出现并发症;观察咯血的量、颜色、性质及咯血的难易程度,注意监测生命体征和意识状态的变化。及时发现并处理呼吸衰竭、气胸、窒息等严重情况,密切观察患者用药后的反应。
(3)咯血抢救
备好抢救物品及药品,如氧气、吸引器、舌钳、开口器及抢救设备和止血、止咳、镇静、呼吸兴奋剂等药物。其中一条给予静脉滴注止血药物,另一条给予补充血容量或抗感染、抗痨药物,护理人员应分工明确,相互协作。保持呼吸道通畅采取患侧卧位或平卧位,头偏向一侧,嘱患者将气管内积血咯出。
(4)窒息抢救
备密切观察咯血量、颜色、性状,咯出的血有血块或坏死组织时是窒息先兆;当病人出现精神紧张,面色灰暗紫绀,喷射出血突然中止,呼吸变得浅促应警惕窒息的发生。要立即采取头低足高位,轻拍其背部,必要时使用开口器,用吸引器迅速吸出咽喉部的血块或行气管切开,以解除呼吸道梗阻。同时给予高流量氧气吸入,氧流量6~8L/min。纠正缺氧状态,如呼吸表浅则给予呼吸兴奋剂或采取辅助呼吸,以维持正常气体交换。
(5)用药治疗
大咯血的止血药首选仍然是垂体后叶素,因其含加压素可使肺小动脉收缩,减少肺循环血流量,降低肺静脉压,使肺小血管破裂、出血处血栓形成而止血。因本药可使包括冠状动脉在内的动脉平滑肌及子宫平滑肌收缩,所以有高血压、冠心病者及妊娠时应禁用。另外,还可以联合使用氨甲苯酸、巴曲酶、云南白药等止血药物。
(6)心理支持
护士要安慰病人,解除紧张心理,树立战胜疾病的信心,配合治疗护理。对大量咯血病人护士应守护在患者身边,给予安慰,鼓励病人将口中的血液或痰液咯出,积极配合治疗抢救。
(7)饮食支持
大咯血期间要禁食,咯血停止后也要杜绝较烫的食物和饮料,避免浓茶、咖啡等刺激性饮料,要用温热清淡的流质饮食,其次是一定量的新鲜蔬菜和水果,食物合理搭配,保证色香味俱全,鼓励病人多饮水。
(8)出院指导
因肺结核治疗周期长,一部分病人因经济困难不能长期住院治疗,而是回家服药,因此出院指导至关重要。再次向病人说明坚持服药完成疗程是治愈肺结核的关键。嘱病人注意劳逸结合,活动后不感劳累为原则,低热的患者以卧床休息为主,做到心情开朗,注意饮食营养。预防疾病复发,一旦发现疲劳,咳嗽、咯血或其他呼吸道症状时及时去医院复查胸片和肝、肾功能,以了解病情变化,及时调整治疗方案。
十一、流行病学
Tuberculosis—the leading cause of death worldwide from an infectious disease among adults—has been considered a global public health emergency for the past 25 years.1 Although public health approaches to tuberculosis have saved tens of millions of lives, modest progress has been made to control (let alone to end) tuberculosis. Drug-resistant forms of tuberculosis are currently on course to be the world’s deadliest pathogens, responsible for a quarter of deaths due to antimicrobial resistance[26]. Great ambition and radical action are needed to tackle this completely curable pathogen, which remains one of the greatest health problems in the world.[27]

1. 全球
图22 2017年全球各地区肺结核新发病数(单位:10万人)
结核病继续在全球造成相当大的发病率和死亡率。根据世卫组织的数据[28],2017年估计有1000万人新患结核病;其中870万人(87%)居住在30个高负担国家。在这1000万人中,只有640万人得到了诊断和正式通知。据估计,每年有130万人死于结核病30。
结核病是一种贫困疾病。虽然大多数高收入国家估计结核病发病率每年不到10/10万人口,但30个结核病负担高的国家(主要是低收入和中等收入国家)估计集体结核病发病率为183/10万人口,其中8个国家的发病率超过400/10万人口30。在国家内部,结核病负担也主要由最贫穷的人承担[29]。
全球结核病发病率估计每年缓慢下降1.6%,远低于实现世卫组织结核病战略目标所需的4-5%。死亡率以每年4.1%的速度下降得更快。关于结核病全球疾病负担、伤害和风险因素的数据(1990-2016)显示[30],如果目前发病率趋势继续下去,很少有国家可能达到联合国可持续发展目标的目标,即到2030年结束结核病流行。
在许多情况下,耐药结核病也是结核病控制工作的主要威胁。每年有50多万人患上耐利福平结核病,但在2017年,只有160684人被诊断或通报,只有139114人开始治疗30。目前,在俄罗斯、缅甸、中国和南非等几个关键国家,耐利福平结核病的患病率正在上升。
十二、人文
1. 肺结核现状

以下用思维导图对肺结核现状进行总结,包括肺结核疫情特点、防治工作质量和对肺结核防治工作的建议(图23)。
图24 肺结核现状33
2. 肺结核的自我歧视和社会歧视
(1)概念
由于结核病属于传染性疾病,公众容易给结核病患者贴上“传染源”标签,将患者从一般人群中区别对待。患者因为负面对待或者预期会受到负面对待而产生被排斥、被拒绝、被责难、被贬低和羞耻、有罪感,这些负面感受综合在一起即自我歧视。社会歧视是指外界对患者施加的影响,其可以损害患者的自尊、自我效能及自信心,造成患者的社交回避和隐瞒病情,进而影响患者的治疗和服药依从性[31]。
(2)表现形式
自我歧视表现形式为患者在患病后,会对因为周围或预期周围人态度的变化过于敏感和在乎。大部分结核病患者患病后担心自己及家人被歧视或自己传染家人。
另一种表现形式为隐瞒病情,而隐瞒病情行为给结核病的防制工作增加了不少难度。竺丽梅等发现上海186例结核病患者中,有60.8%的患者对邻居完全隐瞒病情,43%(68/158)的患者对同事完全隐瞒,29%的患者对朋友完全隐瞒[32]。
结核病的社会歧视主要表现在患者社交、工作等方面受到的外界影响。Jagg Rajamma K发现276例肺结核患者中,有1/3不愿意参加社交活动并认为受到歧视。在252个向家人公开自己病情的患者中,有24%的患者认为家人对自己有歧视的现象140个向社区公开病情的患者中,54%的患者认为自己受到歧视;而向单位公开病情的患者中,26%的患者没有继续留在原工作[33]。
3. DOTS
肺结核病已成为农村因病致贫、因病返贫的重要因素。控制肺结核病的最好方法是实行全程督导化疗(Directly Observed Therapy Short-course,DOTS),优点是可以提高患者治愈率,阻断肺结核病的传播,减少耐药病例的发生,目前已经成为国内外控制和消灭肺结核病的主要手段。
(1)基本要素
DOTS策略仍然是阻止结核策略的核心。DOTS策略结合了五个要素或基本原则,为了实现有效的结核病控制必须全部执行:
①有效结核病控制的政府承诺。
②在症状人群中使用痰涂片显微镜检查法来发现病例。
③采用一线抗结核药物进行6-8个月的标准化治疗方案,在适当的患者管理条件下给药,包括前两个月的直接观察。
④不间断地提供所有必要的抗结核药物。
⑤标准化记录和报告制度,允许监测和评价治疗效果。
DOTS策略框架的五个要素可应用于耐药结核的治疗。DOTS方案确保二线药物的安全使用和综合治疗体系适当应用。如果没有这个策略方针,药品供应可能变的不稳定,记录可能是不恰当的,且二线药物的使用风险变的不合理,这些都会导致二线药物的耐药性。二线药物只能按照世界卫生组织协议公布的治疗耐多药结核的标准化或个体化直接督导下短程化疗的治疗方案来使用。基于DOTS的有效结核病控制是抵抗耐药性的第一步。
4. 治疗效果判断标准
(1)初、复治肺结核
①治愈
涂阳肺结核患者完成规定的疗程,连续2次痰涂片结果阴性,其中1次是治疗末。
②完成疗程
涂阴肺结核患者完成规定的疗程,疗程末痰涂片检查结果阴性或未痰检者;涂阳肺结核患者完成规定的疗程,最近一次痰检结果阴性,完成疗程时无痰检结果。
③结核死亡
活动性肺结核患者因病变进展或并发咯血、自发性气胸、肺心病、全身衰竭或肺外结核等原因死亡。④非结核死亡
结核病患者因结核病以外的原因死亡。
⑤失败
涂阳肺结核患者治疗至第5个月末或疗程结束时痰涂片检查阳性的患者。
(2)耐多药结核
①治愈
符合下列条件之一者:
a)患者完成了疗程,在疗程的后12个月,至少5次连续痰培养阴性,每次间隔至少30天;
b)患者完成了疗程,在疗程的后12个月,仅有一次痰培养阳性,而这次阳性培养结果之后最少连续3次的阴性培养结果,其间隔至少30天:且不伴有临床症状的加重。
②完成治疗
患者完成了疗程,但由于缺乏细菌学检查结果(即在治疗的最后12个月痰培养的次数少于5次),不符合治愈的标准。
③失败
a)治疗的最后12个月5次痰培养中有两次或两次以上阳性;
b)治疗最后的3次培养中有任何一次是阳性;
c)临床决定提前中止治疗者(因为不良反应或治疗无效)。
④丢失
由于任何原因治疗中断连续2个月或以上。
⑤迁出
病人转诊到另一个登记报告的机构。
⑥死亡
在治疗过程中病人由于任何原因发生的死亡。
(3)出院标准
①临床症状好转。
②患者可耐受制定的抗结核治疗方案。
- Dheda K, Barry CE 3rd, Maartens G. Tuberculosis[J]. Lancet. 2016;387(10024):1211-1226. ↑
- 张凤名,肖纯凌,彭宜红主编.医学微生物学[M].北京:北京大学医学出版社,2018:191-195. ↑
- 步宏,李一雷主编.病理学[M].北京:人民卫生出版社,2018:341-343. ↑
- Russell, D.G. Mycobacterium tuberculosis: Here today , and here tomorrow[J]. Nat. Rev. Mol. Cell Biol. 2001,2, 569–577. ↑
- Chan, J.; Flynn, J. The immunological aspects of latency in tuberculosis[J]. Clin. Immunol. Orlando Fla 2004,110, 2–12. ↑
- Cai L, Li Z, Guan X, Cai K, Wang L, Liu J, Tong Y. The Research Progress of Host Genes and Tuberculosis Susceptibility[J]. Oxid Med Cell Longev. 2019 Aug 14;2019:9273056. ↑
- J. J. Yim and P. Selvaraj, Genetic susceptibility in tuberculosis[J], Respirology, vol. 15, no. 2, pp. 241–256, 2010. ↑
- M. J. Ma, W. Liu, and W. C. Cao, Host susceptibility genes of tuberculosis[J], Zhonghua Liu Xing Bing Xue Za Zhi, vol. 32, no. 7, pp. 650–656, 2011. ↑
- E. G. Hoal, L. A. Lewis, S. E. Jamieson et al., SLC11A1(NRAMP1) but not SLC11A2 (NRAMP2) polymorphisms are associated with susceptibility to tuberculosis in a high-incidence community in South Africa[J], The International Journal of Tuberculosis and Lung Disease, vol. 8, no. 12,pp. 1464–1471, 2004. ↑
- C. M. Li, S. J. Campbell, D. S. Kumararatne et al. Association of a polymorphism in the P2X7gene with tuberculosis in a Gambian population[J]. The Journal of Infectious Diseases, vol. 186, no. 10, pp. 1458–1462, 2002. ↑
- S. L. Fernando and W. J. Britton. Genetic susceptibility to mycobacterial disease in humans[J]. Immunology and Cell Biology, vol. 84, no. 2, pp. 125–137, 2006. ↑
- X. Zheng, T. Li, Y. Chen et al. Genetic polymorphisms of the, P2X7, gene associated with susceptibility to and prognosis of pulmonary tuberculosis[J]. Infection, Genetics and Evolution, vol. 53, pp. 24–29, 2017. ↑
- 陆再英,钟南山主编.内科学[M].北京:人民卫生出版社,2018:64. ↑
- 高孟秋.咯血的病因和治疗进展[J].中国医刊,2001(02):18-21. ↑
- 钟勇玲.探讨肺结核咯血的发病机制及治疗[J].中国药物经济学,2013(04):70-71. ↑
- 陆再英,钟南山主编.内科学[M].北京:人民卫生出版社,2018:65. ↑
- 中国疾病预防控制中心.中国结核病防治规划痰涂片镜检质量保证手册[M].北京:中国协和医科大学出版社,2004:5-19. ↑
- 李凡,徐志凯主编.医学微生物学[M].北京:人民卫生出版社,2018:139-140. ↑
- 杨鲁琦,沈鸣逸,沙巍,陈颖盈,王颖.卡介苗的免疫保护机制及其改造策略进展[J].中国防痨杂志,2020,42(08):863-868. ↑
- 姜燕.卡介苗素综合治疗扁平优的疗效观察[J].中国医药论坛,2006,4(9):26-27. ↑
- 谌小江.肺结核的发病现状及预防控制对策[J].基层医学论坛,2015,19(03):427-428. ↑
- Kerry RG, Gouda S, Sil B, Das G, Shin HS, Ghodake G, Patra JK. Cure of tuberculosis using nanotechnology: An overview. J Microbiol. 2018 May;56(5):287-299. ↑
- 耐药结核病化学治疗指南(2019年简版)[J].中国防痨杂志,2019,41(10):1025-1073. ↑
- Abrahams KA, Cox JA, Spivey VL, et al. Identification of novilladas[1,2-a]pyridine inhibitors targeting M. tuberculosis QcrB[J]. PLoS One,2012,7(12):e52951. ↑
- 任丽萍.肺结核咯血合并窒息的护理[J].内蒙古中医药,2012,31(15):151-152. ↑
- Review on Antimicrobial Resistance. Tackling drug-resistant infections globally: final report and recommendations[R]. 2016. https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover.pdf (accessed Nov 9, 2018). ↑
- Furin J, Cox H, Pai M. Tuberculosis[J]. Lancet. 2019;393(10181):1642-1656. ↑
- WHO. Global tuberculosis report 2018[R]. Sept 18, 2018. https://www.who.int/tb/publications/global_report/en/ (accessed March 11, 2019). ↑
- Lonnroth K, Jaramillo E, Williams BG, Dye C, Raviglione M. Drivers of tuberculosis epidemics: the role of risk factors and social determinants[J]. Soc Sci Med 2009; 68: 2240–46. ↑
- GBD Tuberculosis Collaborators. Global, regional, and national burden of tuberculosis, 1990–2016: results from the Global Burden of Diseases, Injuries, and Risk Factors 2016 Study[J]. Lancet Infect Dis 2018; 18: 1329–49. ↑
- 彭颖,陈彬,王飞,王伟,刘魁,何铁牛,陈晟.结核病患者的自我歧视和社会歧视概述[J].现代预防医学,2019,46(05):908-910+920. ↑
- 竺丽梅,唐莉红,倪政,等.上海市闵行区结核病患者隐瞒病情行为调查[J].中国公共卫生,2007,23(6):685 -686. ↑
- Jagg Rajamma K, Ramachandran R, Charles N, et al. Psychosocial dysfunction: perceived and enacted stigma among tuberculosis patients registered under revised national tuberculosis counterprogrammed[J]. Indian Journal of Tuberculosis,2008,55(4):179 -187. ↑
